


| Tavole periodiche |
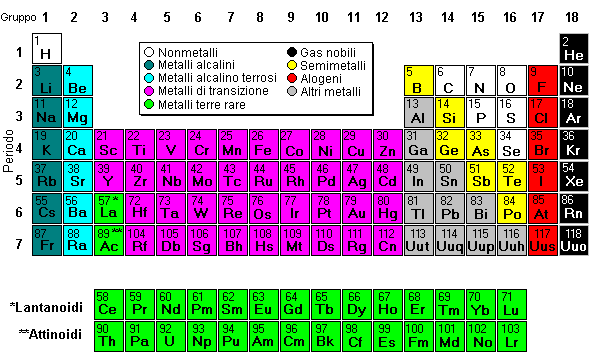
clicca sull'elemento per i dettagli
| Tavole periodiche e legge periodica |
La tavola periodica moderna, basata sul numero atomico e la configurazione elettronica, è stata creata per la prima volta da un chimico russo, Dmitri Ivanovich Mendeleev, e da un fisico tedesco, Julius Lothar Meyer, che lavoravano indipendente l'uno dall'altro Entrambi hanno cioè creato nel 1869 delle tavole periodiche simili a pochi mesi di distanza.
Mendeleev creò la prima tavola periodica basata sul peso atomico. Osservò che molti elementi avevano proprietà simili che si verificavano periodicamente.
La sua legge periodica stabilisce che le proprietà chimiche e fisiche degli elementi variano in modo periodico insieme al loro peso atomico. Quella moderna stabilisce che le proprietà variano insieme al numero atomico, invece che insieme al peso.
Nella tavola di Mendeleev gli elementi furono disposti in righe chiamate periodi. Le colonne furono invece chiamate gruppi. Gli elementi dello stesso gruppo hanno proprietà simili.
La tavola periodica può essere divisa in nove famiglie di elementi, in cui ogni elemento ha proprietà simili. Le famiglie includono:
I metalli alcalini, appartenenti al gruppo 1 della tavola periodica, sono metalli altamente reattivi non presenti liberamente in natura. Questi metalli hanno solo un elettrone nel loro strato elettronico più esterno. Perciò sono pronti a perdere quell'elettrone formando un legame ionico con altri elementi. Come per tutti i metalli, i metalli alcalini sono malleabili, duttili, buoni conduttori di calore e di elettricità. I metalli alcalini sono più morbidi della maggior parte degli altri metalli.
Gli elementi alcalino terrosi sono elementi metallici del secondo gruppo della tavola periodica. Gli elementi alcalini terrosi hanno un numero di ossidazione di +2, il che li rende molto reattivi.
I 38 elementi dei gruppi dal 3 al 12 della tavola periodica si chiamano "metalli di transizione". Come per tutti i metalli, gli elementi di transizione sono sia duttili che malleabili, e conducono l'elettricità e il calore. I loro elettroni di valenza sono presenti in più di uno strato elettronico. Motivo per cui presentano spesso diversi stati di ossidazione in comune.
Gli "altri metalli si trovano nei gruppi 13, 14 e 15. Sono elementi duttili e malleabili, ma non sono uguali agli elementi di transizione. Questi elementi, a differenza degli elementi di transizione, non mostrano stati di ossidazione variabili e i loro elettroni di legame sono presenti solo nello strato più esterno. Tutti questi elementi sono solidi, hanno una densità relativamente alta e sono opachi. Hanno numeri di ossidazione di +3, ±4 e -3.
I semimetalli sono gli elementi posizionati al limite tra i metalli e i nonmetalli. I semimetalli hanno proprietà sia dei metalli che dei nonmetalli. Alcuni semimetalli, come il silicio e il germanio, sono semi conduttori.
I nonmetalli sono gli elementi dei gruppi 14-16 della tavola periodica. I nonmetalli non sono buoni conduttori né di calore né di elettricità. Al contrario dei metalli, i nonmetalli sono molto fragili. I nonmetalli possono essere gas, come l'ossigeno, e solidi, come il carbone. I nonmetalli non hanno una lucentezza metallica e non riflettono la luce. Hanno numeri di ossidazione di ±4, -3 e -2.
Gli alogeni hanno cinque elementi nonmetalli situati nel gruppo 17 della tavola periodica. Tutti gli alogeni hanno 7 elettroni nello strato più esterno, per cui hanno un numero di ossidazione di -1.
I gas nobili si trovano nel gruppo 18 della tavola periodica. Sono elementi che hanno un numero di ossidazione di 0. Per questo non possono formare prontamente dei composti. Tutti i gas nobili hanno 8 elettroni nello strato più esterno e sono perciò stabili.
Le 30 terre rare sono elementi composti dalle serie dei lantanoidi e degli attinoidi. Un elemento della serie dei lantanoidi e la maggior parte degli elementi della serie degli attinoidi sono sintetici, vale a dire fatti artificialmente. Tutte le terre rare si trovano nel gruppo 3 della tavola periodica e nel sesto e settimo periodo.

Home | Downloads | Products | Ordering | Support | Updates | Contact Us | Awards
Our e-mail address is: info@modelscience.com